Vous êtes ici : LGBCLangue-FRLGBCPrésentation et thèmes de recherche
- Partager cette page :
- Version PDF
'Sidéroflexines et mitochondries'
Les mitochondries, bien connues pour leur rôle dans le métabolisme énergétique, assurent des fonctions variées, essentielles pour la survie cellulaire. Ainsi, les mitochondries sont des organites qui régulent des processus fondamentaux tels que le métabolisme des lipides, l’homéostasie calcique, ou encore la mort cellulaire. Ces organites forment un réseau dynamique subissant des remaniements qui sont permis par des mécanismes de fusion et de fission mitochondriale. Des dysfonctionnements des mitochondries ou des altérations de la dynamique mitochondriale sont observés dans diverses pathologies comme les cancers ou des maladies neurodégénératives.
Pour limiter sa toxicité, le fer intracellulaire est stocké par la ferritine et peut être remobilisé, en fonction des besoins cellulaires. Quand les niveaux de fer intracellulaires sont insuffisants, la ferritine est dégradée par les lysosomes grâce à un processus appelé ferritinophagie, conduisant au relargage du fer.
Une dérégulation de l’homéostasie du fer peut se traduire par un excès de fer ayant pour conséquence d’induire un stress oxydatif et éventuellement de favoriser la mort cellulaire par ferroptose (figure 1).
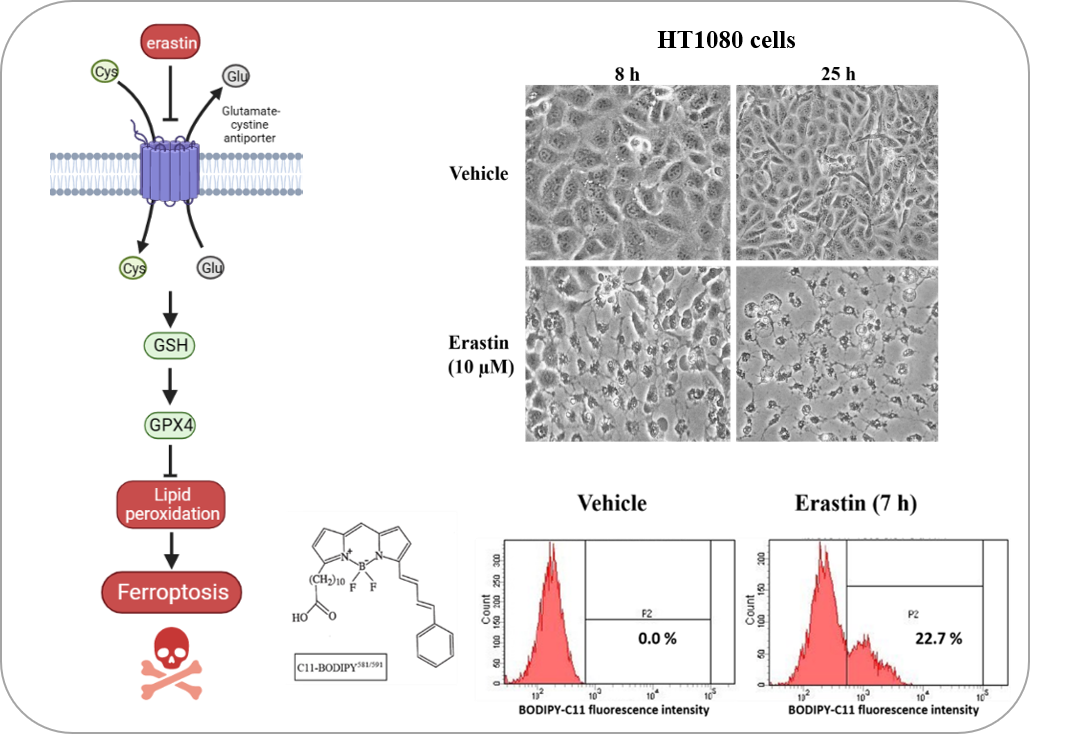
Figure 1: La ferroptose peut être induite par l'érastine, un inhibiteur de l'antiport Glu-Cys (système Xc-). La ferroptose est caractérisée par l’accumulation de lipides peroxydés, détectables à l’aide de la sonde Bodipy-C11 en cytométrie en flux. Schéma réalisé avec BioRender
Nous souhaitons mieux comprendre le rôle des sidéroflexines dans la régulation du métabolisme du fer et décrypter les mécanismes moléculaires impliqués dans cette activité (figure 2). Cette question est abordée dans le cadre du projet collaboratif SiFeMi financé par l’ANR (AAPG2021).
Les objectifs principaux du projet SiFeMi sont de déterminer :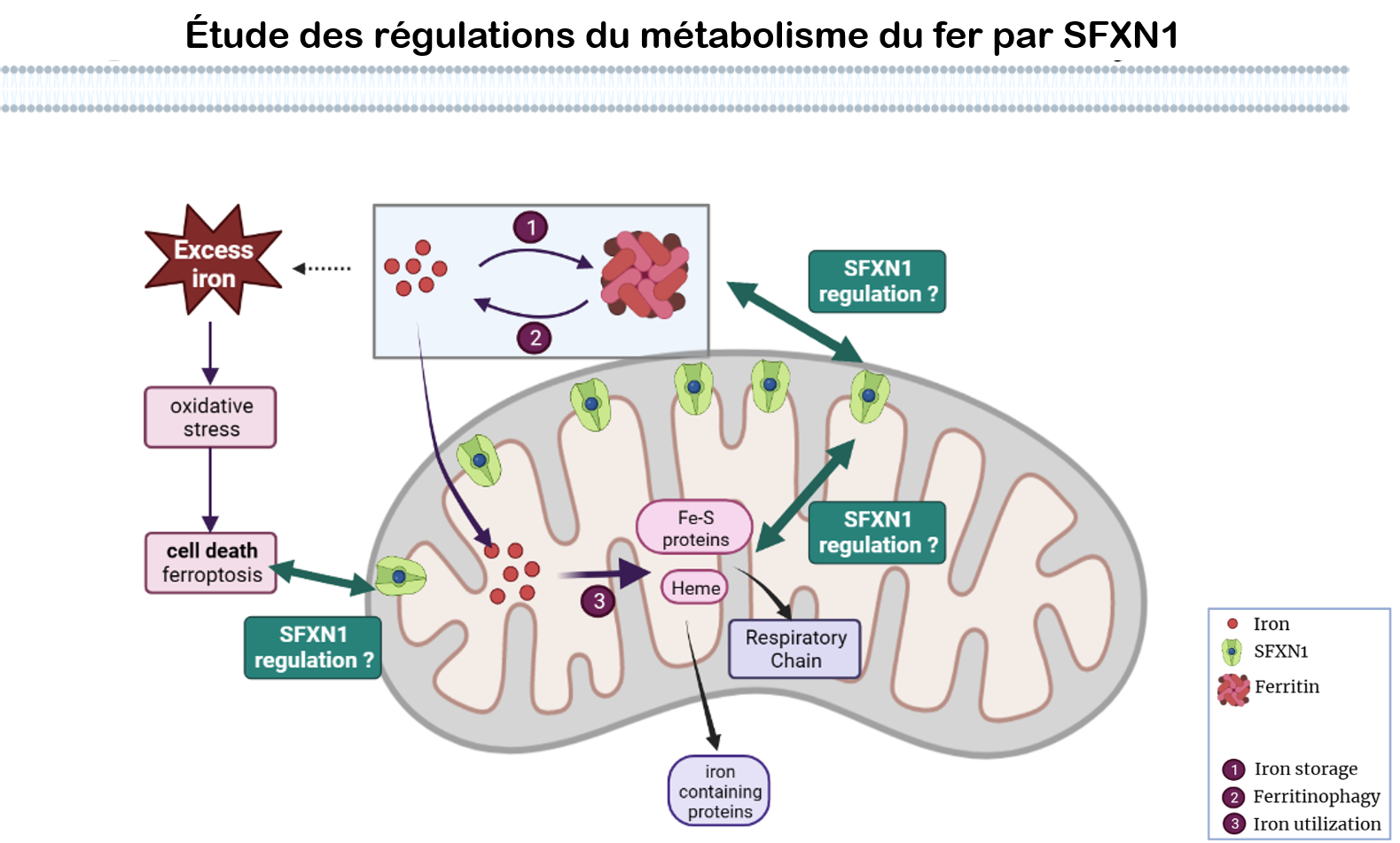 Figure 2: SFXN1 et métabolisme du fer. Schéma réalisé avec BioRender
Figure 2: SFXN1 et métabolisme du fer. Schéma réalisé avec BioRender
- Géraldine Liot (CEA, Fontenay-aux-Roses)
- Marie-Pierre Golinelli-Cohen (ICSN, Gif-sur-Yvette)
- Ioana Ferecatu (Faculté de Pharmacie Paris 5, Paris)
Les sidéroflexines
Le groupe « Sidéroflexines, mitochondries et destin cellulaire » animé par Nathalie Le Floch-Leleu s’intéresse aux fonctions de transporteurs mitochondriaux encore peu étudiés, les sidéroflexines (SFXN). Les sidéroflexines forment la famille de transporteurs de métabolites SLC56, représentée par cinq membres chez les mammifères (SFXN1-5). Les fonctions précises de chaque SFXN sont encore mal comprises même si des données bibliographiques suggèrent que les sidéroflexines régulent le métabolisme du fer.Le métabolisme du fer
Le fer est un élément vital dont les niveaux doivent être finement régulés. En effet, le fer est essentiel pour le fonctionnement de nombreuses protéines, dans lesquelles il est incorporé sous forme de centre fer-soufre ou d’hème. La mitochondrie joue un rôle important dans la biogenèse des centres fer-soufre et dans la biosynthèse de l’hème.Pour limiter sa toxicité, le fer intracellulaire est stocké par la ferritine et peut être remobilisé, en fonction des besoins cellulaires. Quand les niveaux de fer intracellulaires sont insuffisants, la ferritine est dégradée par les lysosomes grâce à un processus appelé ferritinophagie, conduisant au relargage du fer.
Une dérégulation de l’homéostasie du fer peut se traduire par un excès de fer ayant pour conséquence d’induire un stress oxydatif et éventuellement de favoriser la mort cellulaire par ferroptose (figure 1).

Figure 1: La ferroptose peut être induite par l'érastine, un inhibiteur de l'antiport Glu-Cys (système Xc-). La ferroptose est caractérisée par l’accumulation de lipides peroxydés, détectables à l’aide de la sonde Bodipy-C11 en cytométrie en flux. Schéma réalisé avec BioRender
Nos projets
Nous souhaitons mieux comprendre le rôle des sidéroflexines dans la régulation du métabolisme du fer et décrypter les mécanismes moléculaires impliqués dans cette activité (figure 2). Cette question est abordée dans le cadre du projet collaboratif SiFeMi financé par l’ANR (AAPG2021).Les objectifs principaux du projet SiFeMi sont de déterminer :
- L’impact de la modulation des niveaux de SFXN1 sur l’homéostasie du fer
- Le rôle de SFXN1 dans l’intégration des stress conduisant à la mort cellulaire de type apoptose ou ferroptose
- Les conséquences de la modulation des niveaux de SFXN1 sur la physiologie neuronale et la neurodégénérescence
 Figure 2: SFXN1 et métabolisme du fer. Schéma réalisé avec BioRender
Figure 2: SFXN1 et métabolisme du fer. Schéma réalisé avec BioRender
Principaux résultats
- Par une étude bio-informatique, nous avons identifié des motifs putatifs de liaison des protéines IRP dans la région 3’UTR des transcrits SFXN1, suggérant une régulation des niveaux de SFXN1 par le fer.
- Afin d’identifier les partenaires mitochondriaux de SFXN1, nous avons mené une étude protéomique. Cette étude nous a permis d’identifier ATAD3A, une protéine essentielle pour le maintien de la structure mitochondriale, et HSD10, une enzyme mitochondriale régulant la biosynthèse des hormones stéroïdiennes.
- Par une approche génétique chez la drosophile, nous avons montré que la modulation des niveaux des SFXN de drosophile affecte la mort cellulaire induite par la surexpression du gène rbf1 (thèse N.Tifoun).
Modèles utilisés
La recherche des fonctions des sidéroflexines est menée aux échelles moléculaire, cellulaire et de l’organisme entier, en tirant profit de notre expertise sur les modèles cellulaires en culture et le modèle drosophile. Pour pallier aux éventuels problèmes de redondance fonctionnelle, nous nous intéressons également aux fonctions de l’unique sidéroflexine présente chez les levures S. cerevisiae et S. pombe en collaboration avec N. Bonnefoy (I2BC, Gif-sur-Yvette). Enfin, une partie de nos activités vise à comprendre le rôle des sidéroflexines dans la physiopathologie neuronale en utilisant la drosophile, modèle disponible au laboratoire, et des modèles murins en collaboration avec G. Liot (CEA, Fontenay-aux-Rose).Publications récentes
- Tifoun, N. ; Bekhouche, M. ; De las Heras, J.M. ; Guillaume, A.; Bouleau, S. ; Guénal, I. ; Mignotte, B. ; Le Floch, N. A High-Throughput Search for SFXN1 Physical Partners Led to the Identification of ATAD3, HSD10 and TIM50. Biology 2022, 11, 1298. https://doi.org/10.3390/biology11091298
- Tifoun, N. ; De las Heras, J.M. ; Guillaume, A. ; Bouleau, S. ; Mignotte, B. ; Le Floch, N. Insights into the Roles of the Sideroflexins/SLC56 Family in Iron Homeostasis and Iron-Sulfur Biogenesis. Biomedicines 2021, 9, 103. https://doi.org/10.3390/biomedicines9020103
Collaborations en cours
- Nathalie Bonnefoy et Geneviève Dujardin (I2BC, Gif-sur-Yvette)- Géraldine Liot (CEA, Fontenay-aux-Roses)
- Marie-Pierre Golinelli-Cohen (ICSN, Gif-sur-Yvette)
- Ioana Ferecatu (Faculté de Pharmacie Paris 5, Paris)
Membres actuels
Nathalie Leleu
(Responsable)
PR - UVSQ
José de Las Heras Chanes
MC - UVSQ
Florine Adolphe
Enseignante-chercheuse
Mélanie Gonçalves
Assistant Ingénieur - UVSQ
Justine Venelle
Doctorante - UVSQ
(Responsable)
PR - UVSQ
José de Las Heras Chanes
MC - UVSQ
Florine Adolphe
Enseignante-chercheuse
Mélanie Gonçalves
Assistant Ingénieur - UVSQ
Justine Venelle
Doctorante - UVSQ

